1. QU’EST-CE QUE FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : S01ED51
FILIOP collyre en solution est une association de deux substances actives (travoprost et timolol). Le travoprost est un analogue des prostaglandines qui agit en augmentant l’évacuation de liquide de l’œil, ce qui abaisse la pression dans l’œil. Le timolol est un bêtabloquant qui agit en réduisant la production de liquide à l'intérieur de l'œil. Les deux substances agissent ensemble pour réduire la pression à l'intérieur de l'œil. FILIOP collyre est utilisé pour traiter une pression élevée dans l'œil chez les adultes, y compris chez les patients âgés. Cette pression élevée peut provoquer une maladie appelée « glaucome ». FILIOP collyre en solution est une solution stérile sans conservateur.2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution ?
Ne prenez jamais FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution :
· si vous êtes allergique au travoprost, au timolol ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6) ;
· si vous êtes allergique aux prostaglandines ou aux bêtabloquants ;
· si vous avez ou avez eu dans le passé des problèmes respiratoires, p. ex. un asthme, une bronchite chronique obstructive sévère (maladie grave des poumons pouvant provoquer une respiration sifflante, des difficultés respiratoires et/ou une toux persistante) ou d’autres types de problèmes respiratoires ;
· si vous avez un rhume de foins sévère ;
· si vous avez une fréquence cardiaque lente, une insuffisance cardiaque ou des troubles du rythme cardiaque (rythme cardiaque irrégulier) ;
· si la surface de votre œil est trouble.
Demandez conseil à votre médecin si l’une de ces situations vous concerne.
Avertissements et précautions
Adressez-vous à votre médecin ou, pharmacien avant d’utiliser FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution si vous avez ou avez eu dans le passé :· une maladie cardiaque coronarienne (les symptômes peuvent inclure une douleur ou une sensation d’oppression dans la poitrine, un essoufflement ou un étouffement), une insuffisance cardiaque ou une tension artérielle faible ;
· des troubles du rythme cardiaque, p. ex. un rythme cardiaque lent ;
· des problèmes respiratoires, un asthme ou une maladie pulmonaire chronique obstructive ;
· une mauvaise circulation sanguine (p. ex. maladie de Raynaud ou syndrome de Raynaud) ;
· un diabète car le timolol peut masquer les signes et symptômes de taux faibles de sucre dans le sang ;
· une hyperactivité de la glande thyroïde car le timolol peut masquer les signes et symptômes d’une maladie de la thyroïde ;
· une myasthénie grave (faiblesse neuromusculaire chronique) ;
· toute réaction allergique sévère (éruption cutanée, rougeur et démangeaisons au niveau de l’œil) survenant pendant l’utilisation de FILIOP, quelle qu'en soit la cause, le traitement par adrénaline peut ne pas être aussi efficace. Ainsi, si vous recevez tout autre traitement, veuillez avertir votre médecin que vous utilisez FILIOP;
· une chirurgie de la cataracte ;
· une inflammation de l’œil (à l’heure actuelle ou dans le passé).
Avant de subir une opération, avertissez votre médecin que vous utilisez FILIOP car le timolol peut modifier les effets de certains médicaments utilisés pendant l’anesthésie.
FILIOP peut modifier la couleur de l’iris (la partie colorée de l’œil). Cette modification peut être permanente. FILIOP peut provoquer une augmentation de la longueur, de l’épaisseur, de la couleur et/ou du nombre des cils, et peut causer une croissance anormale de poils sur les paupières. Le travoprost peut être absorbé par la peau et il ne doit donc pas être utilisé chez les femmes enceintes ou qui essaient de tomber enceintes. Si le médicament entre en contact avec la peau, il faut laver immédiatement la zone exposée.Enfants
FILIOP ne doit pas être utilisé chez les enfants et les adolescents de moins de 18 ans.Autres médicaments et FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament. FILIOP peut modifier l’action d’autres médicaments ou d’autres médicaments peuvent modifier l’action de FILIOP, y compris d’autres collyres destinés au traitement du glaucome. Avertissez votre médecin si vous utilisez ou avez l’intention d’utiliser :· des médicaments pour abaisser la tension artérielle ;
· un médicament pour le cœur, incluant la quinidine (utilisée pour traiter les affections cardiaques et certains types de malaria) ;
· des médicaments pour traiter le diabète ou des antidépresseurs connus sous le nom de « fluoxétine » et « paroxétine ».
FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution avec des aliments et, boissons et de l’alcool
Sans objet.Grossesse - allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant d’utiliser ce médicament. N’utilisez pas FILIOP si vous êtes enceinte sauf si votre médecin l’estime nécessaire. Si vous êtes susceptible de tomber enceinte, vous devez utiliser une contraception adéquate pendant que vous utilisez ce médicament. N’utilisez pas FILIOP si vous allaitez. Ce médicament peut se retrouver dans votre lait.Conduite de véhicules et utilisation de machines
Vous pouvez constater que votre vision est floue pendant un certain temps, juste après avoir utilisé FILIOP. Ne conduisez aucun véhicule et n’utilisez aucune machine jusqu’à la disparition des symptômes.FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution contient de l’hydroxystéarate de macrogolglycérol 40 et du propylène glycol
Ce médicament contient de l’hydroxystéarate de macrogolglycérol 40, qui peut causer des réactions cutanées. Ce médicament contient 7,5 mg de propylène glycol dans chaque ml de solution.3. COMMENT UTILISER FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
La dose recommandée est
Une goutte dans l’œil/les yeux atteint(s), une fois par jour le matin ou le soir. Utilisez le médicament à la même heure chaque jour. N’utilisez FILIOP dans les deux yeux que si votre médecin vous a dit de le faire. Utilisez-le aussi longtemps que votre médecin vous dit de le faire. N’utilisez FILIOP qu’en gouttes pour les yeux.Instructions d’utilisation
|
1a
|
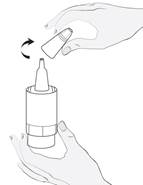
Sortez le flacon (image 1a) de l’emballage et écrivez la date d’ouverture sur la boîte en carton et sur le flacon à l’endroit prévu. |
|
|
Prenez le flacon de médicament et un miroir. Lavez vos mains. Enlevez le capuchon (image 1b). |
|
|
Tenez le flacon vers le bas, en plaçant le pouce sur le rebord du flacon et les autres doigts sur le fond du flacon. Avant la première utilisation, actionnez la pompe du flacon de manière répétitive, environ 10 fois, jusqu’à ce que la première goutte sorte (image 2). |
|
3 |
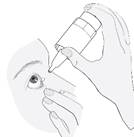
Inclinez la tête en arrière. Tirez la paupière vers le bas à l’aide d’un doigt propre, jusqu’à ce qu’il y ait une sorte de « poche » entre la paupière et l’œil. C’est à cet endroit que la goutte doit tomber (image 3). Tenez l’extrémité du flacon près de l’œil. Utilisez le miroir si cela vous aide. |
|
|
Ne touchez pas votre œil ni votre paupière, ni les zones avoisinantes ou d’autres surfaces avec le compte-gouttes. Cela pourrait contaminer le collyre. Appuyez doucement sur le fond du flacon pour libérer une goutte du médicament à la fois (image 4). Si une goutte ne tombe pas dans l’œil, essayez à nouveau. |
|
|
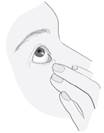
Après l’utilisation du médicament, pressez le coin de l’œil situé du côté du nez pendant 2 minutes avec un doigt (image 5). Cette manœuvre aide à arrêter l’absorption du médicament dans le reste du corps. |
|
|
Si vous utilisez les gouttes dans les deux yeux, répétez ces étapes pour l’autre œil. Fermez bien le capuchon du flacon, juste après l’utilisation. N’utilisez qu’un seul flacon à la fois. N’ouvrez le capuchon qu’au moment où vous avez besoin d’utiliser le flacon. Afin de prévenir les infections, vous devez jeter le flacon 28 jours après sa première ouverture et utiliser un nouveau flacon. |
Si vous avez utilisé plus de FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution que vous n’auriez dû
Si vous avez utilisé plus de FILIOP que vous n’auriez dû, rincez votre œil à l’eau chaude. N’appliquez plus aucune goutte jusqu’au moment de la dose habituelle suivante.Si vous oubliez d’utiliser FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution
Si vous oubliez d’utiliser FILIOP, continuez le traitement en appliquant la dose suivante au moment habituel. N’utilisez pas de dose double pour compenser la dose que vous oublié d’utiliser. La dose ne doit pas dépasser une goutte par jour dans l’œil/les yeux atteint(s).Si vous arrêtez d’utiliser FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution
Si vous arrêtez d’utiliser FILIOP sans en parler à votre médecin, la pression dans votre œil ne sera pas contrôlée, ce qui pourrait provoquer une perte de la vision. Si vous utilisez un autre collyre, attendez au moins 5 minutes entre l’application de FILIOP et celle de l’autre collyre. Si vous portez des lentilles de contact souples, n’utilisez pas le collyre avec vos lentilles en place. Après avoir utilisé le collyre, attendez 15 minutes avant de remettre vos lentilles. Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Vous pouvez généralement poursuivre l’utilisation du collyre sauf si les effets sont graves. Si vous avez la moindre inquiétude, consultez votre médecin ou votre pharmacien. N’arrêtez pas l’utilisation de FILIOP sans en parler d’abord à votre médecin.Très fréquent (pouvant toucher plus de 1 personne sur 10) :
-Effets au niveau de l’œil : rougeur oculaire
Fréquent (pouvant toucher jusqu’à 1 personne sur 10) :
-Effets au niveau de l’œil : inflammation de la surface de l’œil avec une atteinte superficielle, douleur oculaire, vision floue, vision anormale, sécheresse de l’œil, démangeaisons au niveau de l’œil, inconfort oculaire, signes et symptômes d’irritation oculaire (p. ex. brûlure, picotements).
Peu fréquent (pouvant toucher jusqu’à 1 personne sur 100) :
-Effets au niveau de l’œil : inflammation de la surface de l’œil, inflammation de la paupière, gonflement de la conjonctive, augmentation de la croissance des cils, inflammation de l’iris, inflammation de l’œil, sensibilité à la lumière, altération de la vision, fatigue oculaire, allergie oculaire, gonflement oculaire, augmentation de la production de larmes, rougeur de la paupière, modification de la couleur de la paupière.
-Effets indésirables généraux :
allergie médicamenteuse, étourdissements, maux de tête, augmentation ou diminution de la tension artérielle, essoufflement, croissance excessive des poils, écoulement dans l’arrière-gorge, inflammation et irritation de la peau, diminution de la fréquence cardiaque.
Effets indésirables rares (pouvant toucher jusqu’à 1 personne sur 1 000) :
-Effets au niveau de l’œil : amincissement de la surface de l’œil, inflammation des glandes de la paupière, rupture des vaisseaux sanguins dans l’œil, croûte sur le bord de la paupière, position anormale des cils, croissance anormale des cils.
-Effets indésirables généraux :
nervosité, rythme cardiaque irrégulier, perte de cheveux, troubles de la voix, difficultés respiratoires, toux, irritation de la gorge, urticaire, anomalies des résultats des tests sanguins évaluant la fonction du foie, coloration anormale de la peau, assombrissement de la peau, soif, fatigue, inconfort à l’intérieur du nez, urines colorées, douleur dans les mains et les pieds.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
-Effets au niveau de l’œil : paupière tombante (rendant l’œil à moitié fermé)
-Effets indésirables généraux : éruption cutanée, insuffisance cardiaque, douleur dans la poitrine, accident vasculaire cérébral, évanouissement, dépression, asthme, augmentation de la fréquence cardiaque, engourdissement ou picotements, palpitations, gonflement des membres inférieurs, mauvais goût dans la bouche.
De plus :
FILIOP est une association de 2 substances actives. Comme d’autres médicaments s’appliquant dans l’œil, le travoprost et le timolol (un bêtabloquant) sont absorbés dans le sang, ce qui peut provoquer des effets indésirables similaires à ceux observés avec les bêtabloquants administrés par voie intraveineuse et/ou orale. L’incidence des effets indésirables après l’administration ophtalmique topique est plus faible qu’après une administration orale (par la bouche) ou intraveineuse, par exemple. Les effets indésirables mentionnés incluent les réactions observées avec la classe des bêtabloquants lorsqu’ils sont utilisés pour traiter des affections de l’œil :-Effets au niveau de l’œil :
inflammation de la paupière, inflammation de la cornée, décollement de la couche située sous la rétine contenant des vaisseaux sanguins suite à une chirurgie de filtration, pouvant causer des troubles de la vision, diminution de la sensibilité cornéenne, érosion cornéenne (atteinte de la couche située à l’avant du globe oculaire), vision double, modification de la couleur de l’iris.
-Effets indésirables généraux :
* Cœur et circulation : rythme cardiaque lent, palpitations, œdème (accumulation de liquide), modification du rythme ou de la vitesse des battements cardiaques, insuffisance cardiaque congestive (maladie cardiaque s'accompagnant d’un essoufflement et d’un gonflement des pieds et des jambes en raison d’une accumulation de liquide), un type de troubles du rythme cardiaque, crise cardiaque, tension artérielle faible, phénomène de Raynaud, froideur des mains et des pieds, diminution de l’apport de sang au cerveau.
* Système respiratoire : constriction des voies respiratoires dans les poumons (principalement chez les patients ayant une maladie préexistante), difficultés respiratoires, nez bouché.
* Système nerveux et troubles généraux : difficultés à dormir (insomnie), cauchemars, perte de mémoire, perte de force et d’énergie.
* Système digestif : troubles du goût, nausées, indigestion, diarrhée, sécheresse de la bouche, douleur abdominale, vomissements.
* Allergie : réactions allergiques généralisées incluant un gonflement sous la peau pouvant survenir à des endroits tels que le visage et les membres et pouvant causer une obstruction des voies respiratoires et provoquer des difficultés à avaler ou respirer, une urticaire, une éruption localisée et généralisée, des démangeaisons, une réaction allergique grave d’apparition brutale pouvant menacer le pronostic vital.
* Peau : éruption cutanée d’apparence blanc-argenté (éruption psoriasiforme) ou aggravation d’un psoriasis, desquamation de la peau.
* Au niveau des muscles : augmentation des signes et symptômes de myasthénie gravis (affection musculaire), sensations inhabituelles telles que des picotements, faiblesse/fatigue musculaire, douleurs musculaires non provoquées par l'exercice.
* Au niveau de la reproduction : dysfonction sexuelle, diminution de la libido.
* Métabolisme : faibles taux de sucre dans le sang.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.5. COMMENT CONSERVER FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et le flacon après « EXP ». La date de péremption fait référence au dernier jour de ce mois. N’utilisez pas ce médicament si vous remarquez que le flacon a été brisé ou endommagé avant sa première ouverture. A conserver à une température ne dépassant pas 25°C. Afin d’éviter les infections, vous devez jeter le flacon 28 jours après l’avoir ouvert pour la première fois et utiliser un nouveau flacon. Inscrivez la date d’ouverture du flacon à l’endroit prévu sur l’étiquette du flacon et la boîte. Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution
· Les substances actives sont : le travoprost et le timolol.
Chaque ml de solution contient 40 microgrammes de travoprost et 5 mg de timolol (sous la forme de maléate de timolol).
· Les autres composants sont :
Mannitol (E421), acide borique, hydroxyde de sodium (pour ajustement du pH), hydroxystéarate de macrogolglycérol (valeur nominale : 40), propylène glycol (E1520), chlorure de sodium et eau purifiée.
Qu’est-ce que FILIOP 40 microgrammes/mL + 5 mg/mL, collyre en solution et contenu de l’emballage extérieur
FILIOP collyre en solution se présente sous la forme d’une solution aqueuse, limpide et incolore, presque sans particules (volume de 2,5 ml) contenue dans un flacon multidose blanc de 5 ml (PP) muni d’une pompe (PP, PEHD, PEBD), d’un cylindre à pression et d’un capuchon (PEHD). Les présentations suivantes du produit sont disponibles : Boîtes contenant 1 ou 3 flacons. Toutes les présentations peuvent ne pas être commercialiséesLaboratoire titulaire de l'Autorisation de Mise sur le Marché
HORUS PHARMA
 Contact
Contact